淺述基因RASSF1B、RASSF1F在腫瘤細胞中轉錄表達及臨床意義
論文導讀::株腫瘤細胞總RNA的提取結果。基因至少存在7個不同的轉錄本(轉錄本A-G)。
論文關鍵詞:腫瘤細胞,RASSF1基因家族,轉錄,RAS家族
近年來較多研究都發現染色體3P21.3等位缺失在肺癌、乳腺癌、鼻咽癌、腎癌等常見腫瘤中頻繁發生,推測該位點可能存在一個或多個腫瘤抑制基因。2000年,Dammnn等 [1]利用酵母雙雜交篩選的方法從3P21.3內120 kb長最小純合缺失區分離出一種能與DNA修復蛋白XPA相互作用的基因,由于其核苷酸序列的碳端(C-terminus)與小鼠RAS相關區域家族1(RAS association domainfamily 1)與小鼠RAS效應蛋白Nore1高度同源,遂命名為RAS相關區域家族1,即RASSF1基因。由于選擇性剪切和不同啟動子的使用,RASSF1基因至少存在7個不同的轉錄本(轉錄本A-G)。有研究發現RASSF1能直接參與細胞周期的調控醫學論文,在體內和體外能抑制細胞生長,并參與誘導細胞凋亡[2]。
最新研究進展揭示,抑癌基因功能的抑制或失活,除了與基因段的丟失,DNA核苷酸序列的錯位、缺失、重組、變換、點突變等機制相關外,還與抑癌基因DNA核苷酸序列中的胞嘧啶核苷酸(C)和鳥嘌呤核苷酸(G)二聯連結中(CpG)的胞嘧啶堿基環中的第5位碳原子上所發生的甲基化具有極其重要的相關性[4]。抑癌基因R ASSF1的表達作用機制已經初步明確,但其轉錄本基因在惡性腫瘤中的作用研究較少,尤其是RASSF1B,RASSFIF在腫瘤細胞中的表達比較還未見相關報道。本文旨在通過RT-PCR的方法,檢測五種常見的腫瘤細胞中RASSF1家族中RASSF1B,RASSF1F不同轉錄本的表達情況,為基因治療提供理論基礎。
1 試驗材料與方法
1.1 試驗材料
5株腫瘤細胞AGS(胃腺癌)、95D(高轉移肺癌)、LTEP-a-2(肺腺癌)、HEPG2(肝癌)和U937(白血病細胞)購自中國科學院典型培養物保藏委員會細胞庫;MMLV反轉錄試劑盒購于Promega公司。
1.2細胞培養
試驗所選用的五種腫瘤細胞用DMEM(Invitrogen)加10 %小牛血清,CO2培養箱中37 ℃恒溫培養至細胞均勻覆蓋細胞瓶約3/4。
1.3cDNA的制備
以Trizol提取的方法提取細胞總RNA并純化, 用MMLV反轉錄得到五種腫瘤細胞的cDNA。
1.4 RT-PCR
利用DNAstar軟件設計RASSF1家族兩種轉錄本的特異引物,以人β-actin為內參,通過RT-PCR方法檢測這兩種轉錄本在五種腫瘤細胞中的表達情況論文的格式。引物序列見表1。反應條件:95 ℃ 2 min,94 ℃ 15 s,58 ℃ 30 s 醫學論文,72 ℃ 1.5 min 30個循環,72 ℃ 10 min。產物用1%瓊脂糖凝膠電泳檢測。
1.5 應用生物信息學軟件分析7種轉錄本的剪切方式。
2 結果
2.1 兩種轉錄本的讀碼框結構的比較
表1 擴增RASSF1的兩種轉錄本的引物設計
|
基因 異構體 |
GenBank 登錄號 |
引物 Forward (F)/ Reverse (R) |
讀碼框長度(bp) |
擴增片段長度(bp) |
|
B |
NM_170712 |
F:atgagcttgaacaaggacgg |
570 |
591 |
|
R:tccacctgggggtacaagagg |
||||
|
F |
NM_170716 |
F:atgtcgggggagcctgagct |
279 |
281 |
|
R:ggtcaggtgtctcccactccac |
||||
|
actin |
AK225414 |
F:gagaccttcaacaccccagcc |
1656 |
512 |
|
R:gGCgtacaggtctttgcggatg |
根據GenBank中搜索的結果,通過公布的2種RASSF1的異構體。其中,兩種轉錄本主要的差別在于中部存在少數氨基酸的不同剪接方式。RASSF1B為N端缺失,RASSF1F缺失了C端的大部分氨基酸(見圖1和表1)。
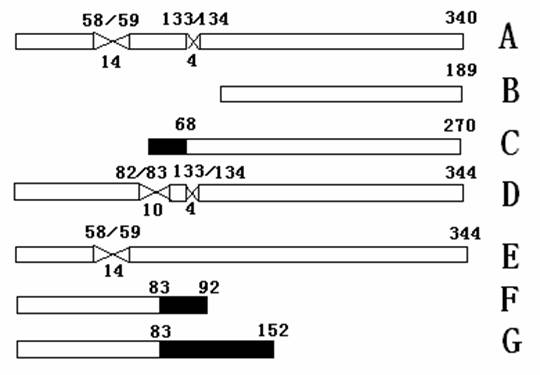
圖1 RASSF1的7種轉錄本的氨基酸結構示意圖。(其中B,F分別表示RASSF1B,RSSF1F)
 代表各自特異的氨基酸序列;結構框上端的數字代表發生變異的氨基酸位點,最后的數字為其讀碼框的長度;交叉線代表缺失的氨基酸,下端的數字為缺失的氨基酸數目。
代表各自特異的氨基酸序列;結構框上端的數字代表發生變異的氨基酸位點,最后的數字為其讀碼框的長度;交叉線代表缺失的氨基酸,下端的數字為缺失的氨基酸數目。
2.2 5株腫瘤細胞總RNA的提取結果
提取了5株腫瘤細胞的總RNA。凝膠電泳的結果顯示,28S和18S條帶較為明顯, RNA的完整性和質量較好(見圖2)。為進一步證實,采用核酸檢測儀(Gene Spec III)檢測,A260/A280值均在1.9 –2.0之間,其結果與電泳的結果一致,各項指標均達到反轉錄要求。

圖2 瓊脂糖電泳檢測總RNA
2.3 2種轉錄本在5種腫瘤細胞中的表達狀況
以5株腫瘤細胞反轉錄獲得的cDNA為模板,應用RT-PCR方法檢測上述2種轉錄本的表達狀況(見圖3)。轉錄本B和F在AGS(胃腺癌)腫瘤細胞中均未見表達。而其他轉錄本在腫瘤中的轉錄有差別,轉錄本B和F在95D(高轉移肺癌)細胞中均有表達醫學論文,表達的強度差別不大,在LTEP-a-2(肺腺癌)、HEPG2(肝癌)細胞中轉錄本B表達較高,而轉錄本F在此兩種腫瘤細胞中未見表達或表達量很低,轉錄本B和F白血病細胞U937中有轉錄。且轉錄本B表達強度較大.從細胞系分析,在此實驗中胃癌細胞AGS幾乎沒有RASSF1B,RASSF1F的轉錄現象。提示2種類型轉錄本可能與胃癌發生呈負相關。在肝癌和肺癌中2種轉錄本基因表達結果完全不同,所起的作用可能不同.

圖3 2種轉錄本在不同腫瘤細胞系中的PCR擴增比較
細胞:A,AGS;D,95D;H,HEPG2;L,LTEP-a-2;U,U937; B-F表示RASSF1的各種異構體,±表示微量擴增,- 表示陰性,+ 表示陽性。
3 討論
RASSF1B是Ras家族相關的基因主要轉錄本之一,其編碼三個結構域依次為1β、2αβ和外顯子3—6的cDNA全長為1664bp,包含外顯子2γ和外顯子3—6,只編碼RAS相關區域。其生物學功能在進研究中,在研究中發現該基因含有一個Ras結合區域和一個SARAH區域。Ras區域是該家族共有的區域。而RAS通路是所有細胞都具有的一條高度保守的信號傳遞通路論文的格式。蛋白在有活性的GTP結合構象和無活性GDP的結合構象之間轉化, 通過與不同的效應物分子激活多條信號傳遞通路”有關文獻報道醫學論文,RASSF1B是通過該區域以GTP方式直接與Ha-Ras相結合[3]。而SARAH區域可以調節細胞信號轉導[11]。其機制可能與以下途徑有關:(1) 活化的Ras蛋白具有促進生長增殖的作用,RASSF1基因可能通過抑制了Ras的激活途徑而抑制生長、促進細胞凋亡;(2) RASSF1能通過阻斷CyclinD1的積累及細胞周期G1/S期的進展而一步抑制腫瘤生長[4]。 RASSFIF是RASSF1基因家族中研究較少的轉錄本基因,僅在部分腫瘤細胞中被發現,現已明確部分RASSF1基因家族失活主要機制是由于啟動子區5′CpG島的異常高甲基化所致 RASSF1家族高甲基化能通過DNA自身化學修飾方式而抑制RASSF1基因家族的轉錄使其表達缺失,喪失了負性調控細胞周期的功能,使細胞易于發生惡性轉化,促進腫瘤的發生與發展[5]。目前關于RASSF1F基因在正常組織及腫瘤組織中表達情況及生物學功能研究還未見報道。
目前已發現的各轉錄本的結構分析,B和F型是較主要的轉錄本。該類型則可能是由基因突變所致。結合本實驗應用RT-PCR的方法,檢測5種腫瘤細胞中RASSF1家族中2種不同轉錄本mRNA的表達情況。結果表明,2種各轉錄本基因不僅是在不同腫瘤細胞中的表達有較大差異。而且在相同腫瘤細胞中的表達水平并不完全相同.由此提示可能腫瘤細胞存在該類基因的突變,同時說明這2種轉錄本基因可能與抑癌有關。但至于該基因家族7種轉錄本基因在同一腫瘤細胞中哪一種起主要作用,則需進一步通過基因表達的方法,提高各轉錄本基因的表達,可能獲得更直接的實驗證據。相關研究正在進行之中。
[1]Dammann R, Li C, Yoon JH, et al. Epigeneticinactivation of a ras association domain family protein from the lung tumorsuppressor locus 3p21.3[J]. NatGenet, 2000; 25(3):315-319.
[2]Shivakumar L, Minna J,Sakamaki T, et al. The RASSF1A tumor suppressor blocks cell cycle progressionand inhibits cyclinD1 accumulation[J]. Mol Cell Biol, 2002; 22(12):4309-4318.
[3]Newton AC.Seeing twodomains.Curr Biol,1955.5;973.976
[4]Hallberg B,Hayter SI,Downward J.Interaction ofRas and Raf in infect wammalian cells upon extracellular. J BiolChen,1994,269:3913-3916
[5]Whang-peng J, Kao SC, LeeEC, et a1. A specific chromosome defect associated with human small-cell lung cancendeletion3pl4-23[J]. Science, 1982, 215:181-182.

